Energiegewinnung
Ziel des Beitrags ist es, ein Gesamtbild der verschiedenen zellulären Energieströme zu vermitteln und zu vergleichen, wie effizient sie den Körper mit dem versorgen, was er braucht, wie viele Ressourcen Sie verbrauchen und welche davon für Ihren Körper am besten geeignet sind, um die Gesundheit zu fördern.
Wenn dieses Thema für Sie neu ist, empfehle ich zuerst den Beitrag zu den Mitochondrien zu lesen, um einen allgemeinen Überblick über die Funktion der Mitochondrien zu erhalten und zu erfahren, wie sie mit chronischen Krankheiten zusammenhängt.
Unsere Zellen enthalten Organellen, die als Mitochondrien bezeichnet werden. Sie sind die Energie produzierenden Öfen, die unsere Nahrung in Elektronen und schliesslich in Energie oder ATP (Adenosintriphosphat) umwandeln.
Die Energieerzeugung kann über zwei Hauptwege erfolgen:
- Glykolyse
- Oxidative Phosphorylierung
Für die oxidative Phosphorylierung ist Sauerstoff erforderlich, während der Glykolyse-Weg auch ohne Sauerstoff Energie erzeugen kann. Dies macht die Glykolyse zu einem wichtigen „Notfall“-Energieerzeugungsweg, wenn Zellen unter Stress stehen, wie z. B. bei Verletzungen, Traumata oder Infektionen, wenn der Sauerstoffgehalt beeinträchtigt ist. Die oxidative Phosphorylierung ist jedoch ein weitaus besserer Weg zur Energieerzeugung.
Die Zwei Hauptwege der Energiegewinnung
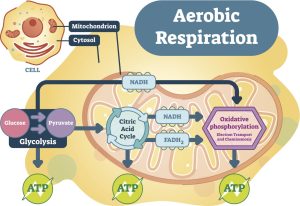
Krebs-Zyklus/Zitronensäure-Zyklus/Tricarbonsäure-Zyklus (TCA) (Krebs Cycle/Citric Acid Cycle/Tricaboxylic Acid Cycle)
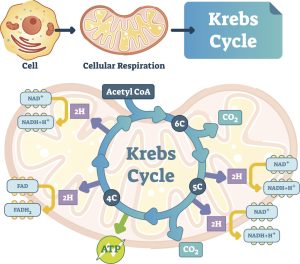
Energiegewinnung durch oxidative Phosphorylierung
Die oxidative Phosphorylierung erfordert Sauerstoff und findet im Rahmen des Krebs-Zyklus/Tricarbonsäure-Zyklus (TCA)/Zitronensäure-Zyklus, wie er manchmal genannt wird, statt. Aus Gründen der Einheitlichkeit werde ich den Begriff Krebs-Zyklus verwenden.
Die Aufgabe des Krebs-Zyklus besteht darin, die Nahrung, die wir zu uns nehmen, mit Sauerstoff zu kombinieren und sie in Zellenergie, Kohlendioxid und Wasser umzuwandeln. Dabei handelt es sich um eine molekulare Redox-Signalreaktion, bei der Redox-Signalmoleküle entstehen, nämlich Wasserstoff, Sauerstoff und Chlorid.
Diese haben folgende Funktionen:
- Die Aktivierung von Antioxidantien, die zur Entgiftung der Zellen benötigt werden
- Sie fungieren als Botenmoleküle, indem sie Aktionen innerhalb und ausserhalb unserer Zellen regulieren
- Wasserstoff kann sich mit NAD (Nicotinamid-Adenin-Dinukleotid/Vitamin B3-abhängig) zu NADH verbinden und sich auch von NADH lösen, um wieder NAD zu bilden. Je mehr Nahrung wir zu uns nehmen, desto mehr Wasserstoff ist verfügbar, um sich mit NAD zu verbinden.
Wenn dieses Gleichgewicht oder diese Homöostase gestört wird, kommt es zu einer beschleunigten Alterung und zur Entwicklung chronischer Krankheiten.
Gealterte Zellen sind Zellen, die zwar noch am Leben sind, aber ihre Arbeit nicht mehr optimal verrichten.
Krankheit entsteht, wenn Zellen dysfunktional werden und Dinge tun, die sie nicht tun sollten.
Die Zellen werden durch Redoxreaktionen angewiesen, sich selbst zu heilen. Sie müssen in Gruppen zusammengeschlossen sein, damit sie sich schnell ersetzen können, wenn sie absterben, und sie müssen (in gesundem Masse) belastet werden, damit sie stärker und widerstandsfähiger werden. Bewegung und Ernährung sind die beiden Dinge, die die Redoxreaktionen mehr als alles andere beeinflussen.
Folgend finden Sie einen Überblick über die Ernährung und wie sie auf den Krebszyklus wirkt:
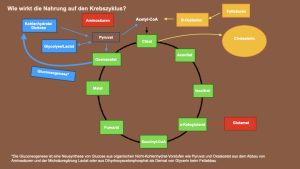
Was ist NADH?
NADH entsteht, wenn sich Wasserstoffmoleküle an NAD binden. Die Wasserstoffmoleküle stammen aus der Nahrungsaufnahme. NADH ist also ein energiereiches Molekül, das durch die Nahrungsaufnahme entsteht.
NADH gelangt in die Elektronentransportkette (ETC – Electron Transport Chain) und erzeugt dabei freie Radikale. Je mehr NADH produziert wird, desto härter arbeiten die Mitochondrien, desto mehr freie Radikale werden produziert. Das ist der Grund, warum Alkohol und übermässiges Essen die Lebenserwartung verkürzen und uns schnell altern lassen. Ein hoher NADH-Gehalt signalisiert dem Körper ausserdem, dass man genug gegessen hat, und kann so das Hungergefühl unterdrücken.
Das Fasten gibt dem Körper die Möglichkeit, den Engpass von überschüssigem NADH zu beseitigen, das in die Elektronentransportkette gelangen will. Das NAD/NADH-Verhältnis schwankt häufig, ist aber ein wichtiges Mass für den Gesundheitszustand der Zellen. Bei Säugetieren liegt das Gesamtverhältnis von NAD:NADH irgendwo zwischen 3-10:1. Wenn das Verhältnis mehr zugunsten von NADH ausfällt, werden vermehrt freie Radikale (z. B. Wasserstoffperoxid – lässt die Haare schneller grau werden) gebildet, und es besteht die Wahrscheinlichkeit von Zellschäden. Ist das Verhältnis hingegen zugunsten von NAD (wie bei der Kalorienrestriktion), wirkt es wie ein Sensor, der Gene reguliert und aktiviert, die für eine längere Lebenserwartung verantwortlich sind, wie z. B. das SIRT-Gen.
Was führt zu einem hohen NADH-Wert?
- Überessen
- Zucker-/Kohlenhydratreiche Ernährung
- Alkohol
- Candidainfektionen
- Sauerstoffarme Zustände
- Hochregulierte Glykolyse
Wann ist ein niedriger NADH-Gehalt wahrscheinlich?
- Längeres Fasten oder Hungern (Vorsicht, nur bei guter Nebennierentätigkeit empfehlenswert)
Wann haben wir eher zu wenig NAD?
- Ernährung mit einem Mangel an B-Vitaminen
- Infektionen (Viren wie Haemophilus influenzae können ihr eigenes NAD nicht herstellen und verwenden daher Ihr NAD)
- Dysbiose des Darms (Candida können kein eigenes NAD herstellen, also verwenden sie Ihres)
- Alterung
Energiegewinnung durch Glykolyse
Wie bereits erwähnt, ist die Glykolyse kein sehr effizienter Energieerzeugungsweg, aber er liefert in Notsituationen schnell Energie.
Einige Zellen haben keine Mitochondrien und sind zum Überleben ausschliesslich auf die Glykolyse angewiesen, z. B. rote Blutkörperchen, Krebs- und Stammzellen. Für jedes Glukosemolekül, das abgebaut wird, werden 2 ATP- und 2 NADH-Moleküle erzeugt. Ausser in den genannten Zellen kommt die
Glykolyse auch bei folgenden Beschwerdebildern zum Einsatz:
- Hefe-/Candidainfektionen
- Schimmelinfektionen/Mykotoxinen
- Schwermetallbelastung
- Viren und Bakterien
- Krebs
- Sauerstoffarme Zustände
- Blockierungen des Krebszyklus
Man beachte, dass die NADH-Produktion nicht so hoch zu sein scheint, aber wenn man das Verhältnis von ATP und NADH betrachtet, heben sie sich gegenseitig auf, d. h. es gibt nicht wirklich zusätzliches ATP, um alles andere besser oder effizienter zu machen. Die Glykolyse ist auch der primäre Weg für die NADH-Produktion, weil er so schnell ist.
In Notfällen, in denen Zellen durch mechanische Verletzungen oder Infektionen geschädigt werden, wird dieser Weg hochreguliert, um die Energieproduktion von der oxidativen Phosphorylierung weg zu verlagern. Das Ziel ist, die Sauerstoffzufuhr der Elektronentransportkette zu verlangsamen, damit weniger freie Radikale (ROS -reactive oxygen species) gebildet werden, um so die Zelle vor weiteren Schäden zu schützen.
Wenn mehr NADH produziert wird, als benötigt wird, weil wir mehr essen, als wir sollten, dann wird die Energieproduktion über diese alternative Glykolyse fortgesetzt und dabei auch freie Radikale produziert – was uns wieder zum Anfang bringt. Dabei endet zellulärer Stress, der schliesslich zum Zelltod führt.
Fettstofwechsel: Die Grundlagen
Fette bestehen aus Fettsäureketten – manche kurz, manche lang – manche mit geraden, manche mit ungeraden Zahlen. Um dies zu verdeutlichen, sagen wir Folgendes:
Während des Fettstoffwechsels werden die geradzahligen einfach gebundenen Fettsäuren durch β-Oxidation zur Energiegewinnung verstoffwechselt und in Acetyl-CoA aufgespalten. Die ungeraden Ketten gelangen über Propionyl-CoA in den Krebszyklus (siehe weiter unten).
Fettsäuren können anhand der Anzahl der Ketten in kurz-, mittel- oder langkettige Fettsäuren eingeteilt werden.Kurzkettige Fettsäuren = 2-6 Ketten. Mittelkettige Fettsäuren = 8-10 Ketten. Langkettige Fettsäuren = 12-24 Ketten

Fettstoffwechsel: NADH und β-Oxidation
Diejenigen, die sich ketogen ernähren, sind vielleicht mit dem Begriff β-Oxidation vertrauter. Bei der β-Oxidation werden Fette abgebaut, wobei Ketone entstehen.
Der Prozess der β-Oxidation erzeugt eine enorme Menge an Energie in Form von ATP und GTP (Guanosintriphosphat). GTP spielt eine wichtige Rolle im Argininweg, der für die Synthese von Stickstoffmonoxid (NO) und damit für die Gefässerweiterung und die Gesundheit des Herz-Kreislauf-Systems verantwortlich ist. Es verbraucht aber auch viele Co-Faktoren wie Vitamin B2 (Riboflavin), B3 (Niacin) und Acetyl-Carnitin und erfordert eine gesunde Schilddrüsenfunktion.
Es handelt sich weitgehend um einen sich selbst erhaltenden Stoffwechselweg, da die Cofaktoren in der Elektronentransportkette (ETC) für einen weiteren Zyklus regeneriert werden. Der geschwindigkeitsbeschränkende Schritt ist die verfügbare Menge an Acetyl-CoA.
Es ist wichtig zu beachten, dass die β-Oxidation den Glukoseabbau hemmt. Das bedeutet, dass sich bei einer fett- und zuckerreichen Ernährung die Glukose in den Blutgefässen anreichert, wodurch der Blutzuckerspiegel steigt, und die Glykolyse durchläuft, wobei Sorbit und andere schädliche Nebenprodukte entstehen, die zu chronischen Krankheiten beitragen. Sie wird mit Sicherheit nicht zur Energiegewinnung abgebaut.
Werden dagegen Kohlenhydrate stark eingeschränkt, wie bei einer ketogenen Diät, beim Fasten oder beim Fastentraining, werden Ketone gebildet, die kein CoA (Coenzym A) benötigen, um in die Mitochondrien zu gelangen. Dadurch wird die Fettverbrennung über einen längeren Zeitraum aufrechterhalten, da der Zustand der Ketose aufrechterhalten wird.
Interessanterweise ist es für den Körper nicht so einfach, ungesättigte Fettsäuren abzubauen. Ungesättigte Fettsäuren haben Doppelbindungen im Gegensatz zu den gesättigten Fettsäuren, die zusätzliche Enzyme benötigen, um die Bindungen zu brechen, bevor sie der β-Oxidation zugeführt werden können. Diese Enzyme können die Position der Doppelbindung nur bei natürlich vorkommenden ungesättigten Fettsäuren mit cis-Konfiguration verschieben, nicht aber bei trans-Konfigurationen (Transfettsäuren – gehärtete Fette wie Margarine).
Dazu kommt, dass mehr NADH produziert wird als bei der Glykolyse, aber wenn man das Verhältnis zwischen ATP und NADH betrachtet, überwiegt die Menge des produzierten ATP bei weitem die der NADH-Produktion. Wenn mehr ATP/Energie zur Verfügung steht, werden die Mitochondrien und andere Organsysteme weniger belastet.
Fettstoffwechsel: Ungeradzahlige Fettsäuren
Diese kommen in Pflanzen und Meeresorganismen vor. Für die Zwecke dieser Erklärung betrachten wir nur den ungerade-nummerierten Teil der Fettsäuren in einer langen Kette von Fettsäuren. Denken Sie daran, dass eine 19-Kohlenstoff-Fettsäurekette eine ungerade Fettsäure ist, aber der grösste Teil davon wird, wie oben erklärt, die β-Oxidation durchlaufen (2-Kohlenstoff-Fettsäuren mit einer Einfachbindung zwischen ihnen).
Da der ungerade-nummerierte Teil der Fettsäure nicht in die β-Oxidation eintritt und Citrat ausscheidet, ist er nicht wirklich an der Cholesterinsynthese beteiligt. Er tritt als Propionyl-CoA und Succinyl-CoA in den Krebszyklus ein, wo er entweder zur Energieproduktion beiträgt oder sich in Richtung Oxalacetat bewegt, wenn Aminosäuren oder Glukose benötigt werden.
Alkohol und NADH
Denken Sie daran, dass ein Überschuss an NADH den Eintritt von Acetyl-CoA in die Mitochondrien hemmt, wodurch auch der Acetyl-CoA-Spiegel im Zytosol steigt. Dies ist einer der Mechanismen, wie Alkohol und übermässiges Essen die Cholesterinproduktion erhöhen. Durch die Erhöhung des NADH-Spiegels wird verhindert, dass die Nahrung in Energie umgewandelt wird, und stattdessen wird die Cholesterinproduktion angekurbelt. Dies ist typischerweise der Fall bei Herz-Kreislauf-Erkrankungen und dem metabolischen Syndrom (Fettleber).
Was ist NADP?
Nicotinamid-Adenin-Dinukleotid-Phosphat ist ein Cofaktor bei anabolen oder aufbauenden Reaktionen wie der Herstellung von Cholesterin und Nukleinsäuren für DNA und RNA. Es ist wichtig, wenn der Körper sich selbst reparieren muss, kann aber auch bei Infektionen und Herz-Kreislauf-Erkrankungen sehr gefragt sein.
Pathogene Organismen wie Viren und Bakterien können die Biochemie des Wirts manipulieren und Wege wie diesen hochregulieren, um mehr Bausteine für sich selbst herzustellen, damit sie wachsen und sich vermehren können.
Bei Herz-Kreislauf-Erkrankungen wird Cholesterin oft im Übermass produziert, um Schäden an den Blutgefässen zu reparieren. Stellen Sie sich Cholesterin als den „Zement“ vor, mit dem die „Schlaglöcher“ geflickt werden. Eine übermässige Schädigung der Blutgefässe durch freie Radikale, die durch den Verzehr von zu viel oder zu wenig antioxidantienreichen Lebensmitteln wie Gemüse verursacht wird, kann den Bedarf an NADP erhöhen und diese Baureaktionen hochregulieren.
Was ist NADPH?
NADPH ist die reduzierte Form von NADP und wird über den Pentosephosphatweg (PPP) bei der Glykolyse gebildet. Es ermöglicht die Regeneration von Glutathion und ist für den antioxidativen Status von grosser Bedeutung. Als reaktives Molekül ist es von Natur aus anabolisch.
Weitere Funktionen von NADPH sind:
- Cholesterin-Synthese
- Erzeugung von freien Radikalen (Superoxid und Wasserstoffperoxid) in Immunzellen zur Bekämpfung von Krankheitserregern.
- Superoxid wiederum verbindet sich mit Stickstoffmonoxid zu Peroxynitrit, das für die Zellen sehr schädlich ist. Das mit Hilfe von NADPH als Cofaktor produzierte und recycelte Glutathion hält dies in Schach.
Fettsynthese: NADPH und die Herstellung von Cholesterin
Cholesterin wird ausserhalb der Mitochondrien im Zytosol hergestellt. Mitochondriale Zwischenprodukte können die Mitochondrienmembran nicht passieren, mit Ausnahme von Citrat. Acetyl-CoA und Oxalacetat verbinden sich innerhalb der Mitochondrien zu Citrat. Citrat durchquert dann die Mitochondrienmembran, um sich erneut in Oxalacetat und Acetyl-CoA aufzuspalten. Oxalacetat wird zur Energiegewinnung wieder in den Pyruvatzyklus eingespeist und erzeugt dabei NADPH. Dieses NADPH wird dann wieder verwendet, um Acetyl-CoA wieder zu Fettsäuren und Cholesterin zusammenzusetzen.
Atherosklerose
NADPH wird für die Regeneration von Glutathion benötigt, und Glutathion ist als Antioxidans für den Schutz und die Reparatur der Blutgefässwände erforderlich. Wenn der Stoffwechselweg die Cholesterinsynthese begünstigt, sei es durch Alkohol, übermässiges Essen, Herunterregulieren von Genen oder Ernährungsmängel, dann bleibt nicht viel NADPH für die Glutathionregeneration übrig. Sie produzieren nicht nur mehr Fettsäuren und Cholesterin, sondern bieten ihnen auch die Möglichkeit, sich an den Blutgefässwänden festzusetzen.
____________________________________________________________________
Referenzen:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC49565/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7905662/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9050893/
https://www.ncbi.nlm.nih.gov/books/NBK482303/
https://www.sigmaaldrich.com/CH/de/technical-documents/technical-article/research-and-disease-areas/metabolism-research/citric-acid-cycle
https://www.msdmanuals.com/professional/endocrine-and-metabolic-disorders/lipid-disorders/overview-of-lipid-metabolism
https://www.chemie.de/lexikon/Fettsäure.html
https://www.chemie.de/lexikon/Photosynthese.html